Equilis® Te
Injektionssuspension für Pferde – Impfstoff gegen Tetanus, inaktiviert
Bezeichnung des Tierarzneimittels
Equilis Te Injektionssuspension für Pferde
Zusammensetzung
Jede Dosis (1 ml) enthält:
Wirkstoff:
Tetanustoxoid 40 LF 1
1 LF = Flockungseinheit; entspricht > 30 IE/ml Meerschweinchenserum im Potency-Test nach Ph.Eur.
Adjuvanzien:
ISCOM-Matrix enthält:
gereinigtes Saponin 375 µg
Cholesterin 125 µg
Phosphatidylcholin 62,5 µg
Klare opaleszente Suspension.
Zieltierart(en)
Pferde.
Anwendungsgebiet(e)
Aktive Immunisierung von Pferden ab einem Lebensalter von 6 Monaten gegen Tetanus, um Todesfälle zu vermeiden.
Beginn der Immunität:
2 Wochen nach der Grundimmunisierung.
Dauer der Immunität:
17 Monate nach der Grundimmunisierung
2 Jahre nach der 1. Wiederholungsimpfung.
Gegenanzeigen
Keine.
Besondere Warnhinweise
Besondere Warnhinweise:
Nur gesunde Tiere impfen.
Besondere Vorsichtsmaßnahmen für die sichere Anwendung bei den Zieltierarten:
Wegen möglicherweise interferierender maternaler Antikörper sollten Fohlen nicht vor einem Lebensalter von 6 Monaten geimpft werden, insbesondere wenn sie von Stuten abstammen, die in den letzten beiden Monaten der Trächtigkeit nachgeimpft wurden.
Besondere Vorsichtsmaßnahmen für den Anwender:
Bei versehentlicher Selbstinjektion ist unverzüglich ein Arzt zu Rate zu ziehen und die Packungsbeilage oder das Etikett vorzuzeigen.
Trächtigkeit und Laktation:
Kann während der Trächtigkeit angewendet werden.
Wechselwirkung mit anderen Arzneimitteln und sonstige Wechselwirkungen:
Die vorgelegten Daten zur Unschädlichkeit und Wirksamkeit belegen, dass der Impfstoff am selben Tag aber nicht gemischt mit Tetanus Serum von Intervet verwendet werden darf (siehe Abschnitt: „Dosierung für jede Tierart, Art und Dauer der Anwendung“).
Es liegen keine Informationen zur Unschädlichkeit und Wirksamkeit des Impfstoffs bei gleichzeitiger Anwendung eines anderen veterinärmedizinischen Produktes vor. Ob der Impfstoff vor oder nach Verabreichung eines anderen veterinärmedizinischen Produktes verwendet werden sollte, muss daher fallweise entschieden werden.
Überdosierung:
Nach Verabreichung der doppelten Impfstoffdosis wurden mit Ausnahme von Abgeschlagenheit am Tag der Impfung keine anderen als die unter Abschnitt „Nebenwirkungen“ beschriebenen Nebenwirkungen festgestellt.
Wesentliche Inkompatibilitäten:
Nicht mit anderen Tierarzneimitteln mischen.
Nebenwirkungen
Pferde:
Selten (1 bis 10 Tiere / 10.000 behandelte Tiere): | Schwellung an der Injektionsstelle1, Schmerzen an der Injektionsstelle2. |
| Sehr selten (< 1 Tier/10.000 behandelte Tiere, einschließlich Einzelfallberichte): | Fieber3, Lethargie3, Appetitlosigkeit3, Überempfindlichkeitsreaktion4. |
1 Eine diffuse harte oder weiche Schwellung (max. 5 cm Durchmesser), die sich innerhalb von 2 Tagen zurückbildet. Eine lokale Reaktion mit einem Durchmesser von mehr als 5 cm kann in sehr seltenen Fällen auftreten und möglicherweise länger als 2 Tage anhalten.
2 Schmerzen an der Injektionsstelle, die zu vorübergehenden Bewegungseinschränkungen (Steifheit) führen können.
3 Fieber, mitunter begleitet von Lethargie und Appetitlosigkeit, kann an einem Tag und in Ausnahmefällen bis zu drei Tage lang auftreten.
4 Einschließlich Anaphylaxie (in manchen Fällen tödlich). Wenn solch eine Reaktion auftritt, sollte unverzüglich eine angemessene Behandlung eingeleitet werden.
Die Meldung unerwünschter Ereignisse ist wichtig. Es ermöglicht eine kontinuierliche Sicherheitsüberwachung eines Produkts. Wenn Sie Nebenwirkungen feststellen, insbesondere solche, die nicht bereits in dieser Packungsbeilage aufgeführt sind, oder falls Sie vermuten, dass das Tierarzneimittel nicht gewirkt hat, teilen Sie dies bitte zuerst Ihrem Tierarzt mit. Sie können Nebenwirkungen auch an den Zulassungsinhaber unter Verwendung der Kontaktdaten am Ende dieser Packungsbeilage oder über Ihr nationales Meldesystem melden.
Dosierung für jede Tierart, Art und Dauer der Anwendung
Eine Dosis (1 ml). Intramuskuläre Anwendung.
Impfschema:
Grundimmunisierung
Nach folgendem Schema je eine Dosis (1 ml) intramuskulär injizieren:
– Grundimmunisierung: die 1. Injektion ab einem Lebensalter von 6 Monaten, die 2. Injektion 4 Wochen später.
Wiederholungsimpfung
Die erste Wiederholungsimpfung ist nicht später als 17 Monate nach der Grundimmunisierung zu verabreichen. Danach wird ein Impfintervall von maximal 2 Jahren empfohlen (siehe Schema).
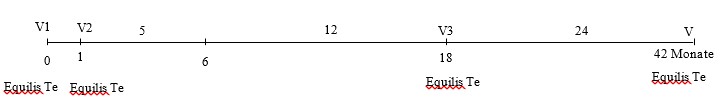
Im Falle eines erhöhten Infektionsrisikos oder einer unzureichenden Kolostrumaufnahme kann eine zusätzliche erste Injektion im Alter von 4 Monaten verabreicht werden, gefolgt von einem vollständigen Impfprogramm (Grundimmunisierung im Alter von 6 Monaten und 4 Wochen später).
Gleichzeitige aktive und passive Immunisierung (Notimpfung)
Der Impfstoff kann gemeinsam mit Tetanus-Serum zur Behandlung von verletzten nicht gegen Tetanus geimpften Pferden eingesetzt werden. In diesem Fall kann die erste Dosis (V1) des Impfstoffes gleichzeitig mit der empfohlenen prophylaktischen Dosis Tetanus-Serum an einer anderen Injektionsstelle unter Verwendung eines separaten Impfbestecks verabreicht werden. Dies führt zu einem passiven Schutz gegen Tetanus für mindestens 21 Tage nach der gleichzeitigen Impfung. Die zweite Dosis des Impfstoffes (V2) sollte 4 Wochen später gegeben werden. Eine dritte Wiederholungsimpfung mit Equilis Te sollte frühestens 4 Wochen danach verabreicht werden. Die gleichzeitige Anwendung von Equilis Te und Tetanus-Serum von Intervet kann die aktive Immunität gegen Tetanus im Vergleich zu Pferden, die nicht zusätzlich mit dem Tetanus-Antitoxin-Serum behandelt wurden, beeinträchtigen.
Hinweise für die richtige Anwendung
Den Impfstoff vor Gebrauch auf Raumtemperatur bringen.
Wartezeiten
Null Tage.
Besondere Lagerungshinweise
Arzneimittel unzugänglich für Kinder aufbewahren.
Im Kühlschrank lagern (2 °C – 8 °C).
Nicht einfrieren.
Vor Licht schützen.
Sie dürfen dieses Tierarzneimittel nach dem auf dem Etikett angegebenen Verfalldatum nach „Exp.“ nicht mehr anwenden. Das Verfalldatum bezieht sich auf den letzten Tag des Monats.
Besondere Vorsichtsmaßnahmen für die Entsorgung
Arzneimittel sollten nicht über das Abwasser oder den Haushaltsabfall entsorgt werden.
Nutzen Sie Rücknahmesysteme für die Entsorgung nicht verwendeter Tierarzneimittel oder daraus entstandener Abfälle nach den örtlichen Vorschriften und die für das betreffende Tierarzneimittel geltenden nationalen Sammelsysteme. Diese Maßnahmen dienen dem Umweltschutz.
Fragen Sie Ihren Tierarzt oder Apotheker, wie nicht mehr benötigte Arzneimittel zu entsorgen sind.
Einstufung von Tierarzneimitteln
Tierarzneimittel, das der Verschreibungspflicht unterliegt.
Zulassungsnummern und Packungsgrößen
EU/2/05/055/001-002
Packungsgrößen:
Faltkarton mit 10 Durchstechflaschen mit 1 ml (1 Dosis).
Faltkarton mit 10 Fertigspritzen mit 1 ml (1 Dosis) und Kanülen.
Es werden möglicherweise nicht alle Packungsgrößen in Verkehr gebracht.
Datum der letzten Überarbeitung der Packungsbeilage
07/2023
Detaillierte Angaben zu diesem Tierarzneimittel sind in der Produktdatenbank der Europäischen Union verfügbar (https://medicines.health.europa.eu/veterinary).
