Mometamax Ultra™ Ohrentropfen, Suspension für Hunde
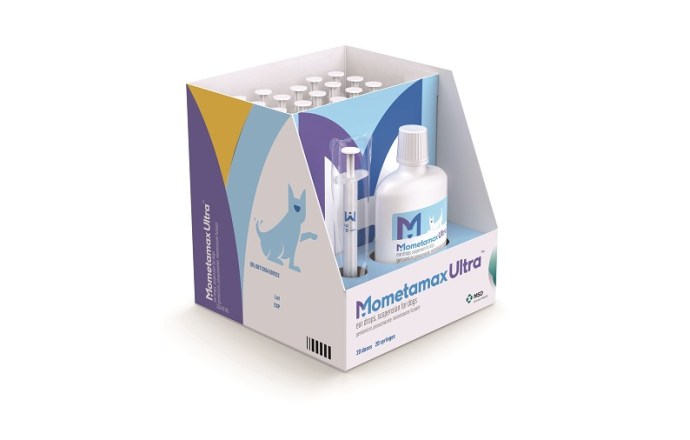
Suspension zum Einbringen in den äußeren Gehörgang für Hunde – Otitis externa Präparat (Gentamicin, Posaconazol, Mometasonfuroat)
Bezeichnung des Tierarzneimittels
Mometamax Ultra™ Ohrentropfen, Suspension für Hunde
Gentamicin, Posaconazol, Mometasonfuroat
Wirkstoff(e) und sonstige Bestandteile
Jede Dosis (0,8 ml) enthält:
Gentamicinsulfat äquivalent zu 6880 IU Gentamicin
Posaconazol 2,08 mg
Mometasonfuroat Monohydrat äquivalent zu 1,68 mg Mometasonfuroat
Ohrentropfen, Suspension.
Weiße bis cremefarbene, viskose Suspension.
Anwendungsgebiet(e)
Zur Behandlung der akuten Otitis externa und akuter Exazerbationen einer rezidivierenden Otitis externa, hervorgerufen durch gemischte bakterielle und Pilzinfektionen mit Gentamicin-empfindlichen Staphylococcus pseudintermedius und Posaconazol-empfindlichen Malassezia pachydermatis.
Gegenanzeigen
Nicht anwenden bei bekannter Überempfindlichkeit gegenüber den Wirkstoffen oder einem der sonstigen Bestandteile, gegenüber Kortikosteroiden, anderen Antimykotika der Azolklasse und anderen Aminoglykosiden.
Nicht anwenden bei perforiertem Trommelfell.
Nicht anwenden bei trächtigen oder für die Zucht vorgesehenen Tieren.
Nicht gleichzeitig mit Substanzen anwenden, die bekanntermaßen Ototoxizität verursachen.
Nicht anwenden bei Hunden mit generalisierter Demodikose.
Nebenwirkungen
In klinischen Studien wurden keine behandlungsbedingten Nebenwirkungen beobachtet.
Falls Sie Nebenwirkungen bei Ihrem Tier feststellen, oder falls Sie vermuten, dass das Tierarzneimittel nicht gewirkt hat, teilen Sie dies bitte Ihrem Tierarzt oder Apotheker mit.
Zieltierart(en)
Hunde
Dosierung für jede Tierart, Art und Dauer der Anwendung
Anwendung am Ohr.
Einmalige Behandlung.
Die empfohlene Dosis ist eine Einzeldosis von 0,8 ml pro infiziertem Ohr.
Ein maximales klinisches Ansprechen ist erst 28 bis 42 Tage nach der Verabreichung zu erwarten.
Hinweise für die richtige Anwendung
Das Tierarzneimittel sollte nur von Tierärzten oder von geschultem Personal unter enger Aufsicht eines Tierarztes verabreicht werden.
Vor der Verabreichung des Tierarzneimittels den äußeren Gehörgang reinigen und trocknen.
Das Tierarzneimittel enthält kein Konservierungsmittel und sollte unter Einhaltung von Reinheitsvorkehrungen verwendet werden.
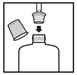
Vor der ersten Anwendung die Flasche 15 Sekunden lang kräftig schütteln. Die Spritze mit dem bereits aufgesteckten Adapter auspacken. Die Kappe von der Flasche entfernen und den Adapter mit der beigefügten Spritze fest in den oberen Teil der Flasche drücken. Befolgen Sie die Schritte 1 bis 5 der Anwendungshinweise.
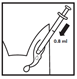
- Die Flasche umdrehen und 0,8 ml pro Ohr aufziehen.
- Die Flasche wieder in eine aufrechte Position bringen und die Spritze vom Adapter nehmen.
- Den Adapter belassen und die Kappe wieder auf die Flasche setzen.
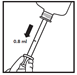
- Die Spitze der Spritze am Eingang des äußeren Ohres positionieren und die Dosis von 0,8 ml verabreichen. Die verabreichte Dosis wird in den Gehörgang fließen.
- Nach der Verabreichung kann das Ohr sanft massiert werden, um die Verteilung des Tierarzneimittels im gesamten Gehörgang sicherzustellen. Nach der Verabreichung sollte der Kopf ungefähr 2 Minuten gehalten werden, um ein Schütteln und Herauslaufen des Tierarzneimittels zu verhindern.
Für jedes infizierte Ohr eine neue Spritze verwenden.
Es wird empfohlen, eine Ohrreinigung für mindestens 28 Tage nach der Verabreichung nicht zu wiederholen, es sei denn, es ist klinisch indiziert. Es sollte auch darauf geachtet werden, dass während dieser Zeit kein Wasser in den Gehörgang gelangt. Deshalb sollten Hunde bis zur Bestätigung der klinischen Heilung 28-42 Tage nach der Behandlung nicht gebadet werden oder schwimmen dürfen.
Hunde sollten 28-42 Tage nach der Verabreichung des Tierarzneimittels erneut untersucht werden, um den Behandlungserfolg zu beurteilen. Nach der Bestätigung der klinischen Heilung sollten die Ohren gereinigt werden, um möglichen Detritus oder Rückstände des Tierarzneimittels zu entfernen.
Wartezeite(en)
Nicht zutreffend.
Besondere Lagerungshinweise
Arzneimittel unzugänglich für Kinder aufbewahren.
Für dieses Tierarzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
Das Tierarzneimittel nach dem auf dem Karton und dem Behältnis angegebenen Verfalldatum nach dem „verwendbar bis“ nicht mehr anwenden.
Haltbarkeit nach dem ersten Öffnen/Anbruch des Behältnisses: 3 Monate.
Besondere Warnhinweise
Besondere Warnhinweise für jede Zieltierart:
Die antimikrobielle Wirkung kann durch einen niedrigen pH und die Anwesenheit von eitrigem und/oder entzündlichem Detritus verringert werden. Die Ohren müssen vor der Verabreichung des Tierarzneimittels gereinigt werden. Eine Kompatibilität mit Ohrreinigern wurde nicht nachgewiesen.
Bakterielle und pilzbedingte Otitiden sind häufig Sekundärerkrankungen. Bei Tieren mit chronisch
rezidivierender Otitis externa in der Vorgeschichte müssen die Grundursachen der Erkrankung, wie
Allergien oder anatomische Gegebenheiten des Ohres, beachtet werden, um eine ineffektive Behandlung mit einem Tierarzneimittel zu vermeiden.
Die Wirksamkeit dieses Tierarzneimittels wurde bei Hunden mit atopischen oder allergischen Hauterkrankungen nicht untersucht.
Zwischen Gentamicin im Tierarzneimittel und anderen Vertretern der Aminoglykosidklasse wurden Kreuzreaktionen bei Staphylococcus pseudintermedius nachgewiesen. Die Anwendung des Tierarzneimittels sollte daher sorgfältig geprüft werden, sofern die Empfindlichkeitsprüfung Resistenzen gegenüber Aminoglykoside gezeigt hat, da dies die Wirksamkeit reduzieren kann. Eine Ko-Selektion für andere Antibiotikaklassen ist häufig.
Besondere Vorsichtsmaßnahmen für die Anwendung bei Tieren:
Die Verträglichkeit des Tierarzneimittels wurde bei Hunden, die jünger als 3 Monate sind oder mit einem Gewicht weniger als 3 kg nicht untersucht.
Vor der Verabreichung des Tierarzneimittels muss der äußere Gehörgang gründlich untersucht werden, um sicherzustellen, dass das Trommelfell nicht perforiert ist. Damit wird das Risiko einer Übertragung der Infektion in das Mittelohr vermieden und eine Schädigung der Gehörschnecke und des Vestibularapparates verhindert.
Den Hund sofort erneut zu untersuchen, wenn sich die klinischen Symptome verschlechtern, Hörverlust oder Anzeichen von Gleichgewichtsstörungen während der Behandlung beobachtet werden oder wenn der Hund nach 14 Tagen noch keine Anzeichen einer Besserung zeigt.
Vor der Anwendung des Tierarzneimittels wird eine zytologische Untersuchung des Gehörganges empfohlen, um eine Mischinfektion zu erkennen.
Diese Kombination antimikrobieller Wirkstoffe sollte nur verwendet werden, wenn diagnostische Tests die Notwendigkeit der gleichzeitigen Verabreichung der einzelnen Wirkstoffe ergeben haben.
Die Anwendung des Tierarzneimittels sollte auf der Identifizierung und Empfindlichkeitsprüfung der Zielerreger basieren. Idealerweise sollte die Anwendung auf epidemiologischen Informationen und Kenntnissen zur Empfindlichkeit der Zielerreger auf Bestandsebene oder auf lokaler/regionaler Ebene beruhen.
Bei der Anwendung des Tierarzneimittels sind die amtlichen, nationalen und örtlichen Regelungen über den Einsatz von Antibiotika zu berücksichtigen.
Wenn eine Überempfindlichkeit gegenüber einem der Bestandteile auftritt, sollte die Behandlung abgebrochen und eine geeignete Therapie eingeleitet werden.
Bei einer parasitären Otitis sollte eine geeignete akarizide Behandlung durchgeführt werden.
Es ist bekannt, dass eine langanhaltende und intensive Anwendung topischer Kortikosteroidpräparate systemische Wirkungen, einschließlich einer Suppression der Nebennierenfunktion, induzieren kann.
Bei Hunden mit vermuteter oder bestätigter endokriner Störung (z.B. Diabetes mellitus; Schilddrüsenerkrankungen, usw.) mit Vorsicht anwenden.
Ototoxizität kann mit der Gentamicinbehandlung verbunden sein. Die Erfahrung zeigt, dass bei geriatrischen Hunden ein höheres Risiko für Hörschäden nach topischer Verabreichung von Ohrpräparaten besteht.
Objektive Untersuchungen des Hörvermögens wurden in der zulassungsrelevanten Feldstudie nicht durchgeführt. Hunde mit Anzeichen eines eingeschränkten Gleichgewichtssinns oder eines Hörverlustes nach der Behandlung sollten erneut untersucht werden.
Besondere Vorsichtsmaßnahmen für den Anwender:
Das Tierarzneimittel kann leicht augenreizend sein. Ein versehentlicher Augenkontakt ist möglich, wenn der Hund während oder kurz nach der Verabreichung seinen Kopf schüttelt. Bei versehentlichem Augenkontakt die Augen 15 Minuten lang mit reichlich Wasser spülen. Sollten Symptome auftreten, ärztlichen Rat einholen und dem Arzt die Packungsbeilage oder das Etikett zeigen.
Obwohl sich in experimentellen Studien kein Potential für eine hautreizende Wirkung zeigte, sollte der Kontakt des Tierarzneimittels mit der Haut vermieden werden. Bei versehentlichem Hautkontakt die betroffene Hautstelle mit Wasser waschen.
Ein enger Kontakt zwischen dem Hund und Kindern sollte in den Tagen nach der Behandlung wegen der unbekannten Menge des Tierarzneimittels, die möglicherweise aus dem/den behandelten Ohr(en) herausläuft, begrenzt werden.
Das Tierarzneimittel kann nach oraler Aufnahme schädlich sein. Vermeiden Sie die Aufnahme des Tierarzneimittels einschließlich der Hand zu Mund Aufnahme. Bei versehentlicher oraler Aufnahme, sofort ärztlichen Rat einholen und dem Arzt die Packungsbeilage oder das Etikett zeigen.
Trächtigkeit und Laktation:
Die Unbedenklichkeit des Tierarzneimittels während der Trächtigkeit und Laktation ist nicht belegt. Nicht anwenden während der Trächtigkeit und Laktation.
Fortpflanzungsfähigkeit:
Studien zur Bestimmung der Wirkung auf die Fruchtbarkeit bei Hunden wurden nicht durchgeführt. Nicht bei Zuchttieren anwenden.
Wechselwirkungen mit anderen Arzneimitteln und andere Wechselwirkungen:
Keine bekannt.
Überdosierung (Symptome, Notfallmaßnahmen, Gegenmittel):
Die Anwendung am Ohr bei Welpen mit bis zum Fünffachen der empfohlenen Dosierung in beide Ohren drei Mal im Abstand von 2 Wochen wurde gut vertragen.
Alle Befunde waren konsistent mit einer Glucokortikoidverabreichung. Die Befunde in den dreifach und fünffach überdosierten Gruppen umfassten ein leichte Eosinopenie, niedrigere Kortisol-Basalwerte und niedrigere ACTH-induzierte Kortisolspiegel, niedrigere mittlere Nebennierengewichte, die mit einer minimalen bis leichten Nebennierenrindenatrophie korrelierten. Eine minimale bis leichte Atrophie der Epidermis des äußeren Gehörganges und des Epithels der äußeren Seite des Trommelfells, in Einklang mit den pharmakologischen Effekten von Glucokortikoiden, konnten in der einfach, dreifach und fünffach dosierten Gruppe beobachtet werden und erwiesen sich als reversibel nach Beendigung der Behandlung. Eine ACTH-Verabreichung am Studienende löste einen Anstieg der Kortisolspiegel in allen Studiengruppen aus, was auf eine ausreichende Nebennierenfunktion hinweist.
Alle Befunde waren von einem geringen Schweregrad und wurden als reversibel nach Behandlungsende erachtet.
Besondere Vorsichtsmaßnahmen für die Entsorgung von nicht verwendetem Arzneimittel oder von Abfallmaterialien, sofern erforderlich
Nicht verwendete Tierarzneimittel oder davon stammende Abfallmaterialien sind entsprechend den nationalen Vorschriften zu entsorgen.
Genehmigungsdatum der Packungsbeilage
22. November 2022
Detaillierte Angaben zu diesem Tierarzneimittel finden Sie auf der Website der Europäischen Arzneimittel-Agentur unter http://www.ema.europa.eu/.
Weitere Angaben
Packungsgröße: 1 Flasche, 20 Spritzen
