
Häufig gestellte Fragen
- Welche Symptome sehe ich durch das PRRS-Virus im Stall?
- Welche finanziellen Schäden verursacht PRRSV?
- Woher weiß ich, ob PRRSV ein Problem in meinem Bestand ist?
- Was bedeutet bei PRRS MLV Impfstoffen eigentlich „alt“?
- Welche Eigenschaften spielen denn bei der Wahl eines PRRSV-Impfstoffes eine Rolle?
- Ist die frühe Ferkelimpfung per se die beste Wahl?
Welche Symptome sehe ich durch das PRRS-Virus im Stall?
Der Name „Porzines Reproduktives und Respiratorisches Syndrom“ (PRRS) benennt die häufigsten Krankheitsbilder die im Zusammenhang mit dem Virus auftreten: Fruchtbarkeitsstörungen bei den Sauen und Atemwegsstörungen hautsächlich bei Ferkeln und Mastschweinen.
Bei der Infektion einer naiven Herde, also einem Schweinebestand ohne vorherigen Kontakt zum PRRS-Virus oder ohne PRRS-Impfung, kann es in allen Altersgruppen zu sehr schweren Erkrankungsverläufen kommen1. In Schweinebeständen, in denen das PRRS-Virus schon längere Zeit vorhanden ist und zirkuliert, sind hauptsächlich Tiere in der Ferkelaufzucht und neu zugeführte Jungsauen von sichtbaren Symptomen betroffen1.
Bei Sauen kommt es nach Viruskontakt mit einem krankmachenden PRRSV-Stamm zu einer Zunahme von totgeborenen, mumifizierten und lebensschwachen Ferkeln, auch die Abferkelrate kann sinken1. Die Sauen selbst können Allgemeinsymptome wie Fieber, Appetitlosigkeit oder Verfärbungen an Ohren oder Vulva zeigen, müssen es aber nicht. Sie können bis auf Reproduktionsstörungen weitestgehend unauffällig bleiben1. Saugferkel, die während der Trächtigkeit in der Muttersau infiziert wurden und überlebt haben, zeigen Lebensschwäche und sind anfällig für weitere Sekundärinfektionen, wie zum Beispiel Streptokokken 1,2.
Die Symptome bei Absetzferkeln und Mastschweinen ähneln denen anderer Atemwegserkrankungen: Die Tiere können Husten, Schweratmigkeit, Appetitlosigkeit und Fieber zeigen. Zusammen mit anderen bakteriellen und viralen Erregern verursacht PRRSV eine häufig vorkommende Komplexerkrankung der Atemwege, den sogenannten Porcine Respiratory Disease Complex (abgekürzt PRDC). Sekundärinfektionen wie Streptokokken oder Glässer werden regelmäßig zusammen mit PRRSV-Infektionen beschrieben1.
Wie schwer die Symptome durch das PRRS-Virus im Stall letztendlich sind, hängt von verschiedenen Faktoren ab, zu denen unter anderem die krankmachenden Eigenschaften des jeweiligen PRRS-Virusstammes, das Alter der Tiere aber eben auch der Immunstatus (naive Herde oder Impfbestand) des einzelnen Tieres aber auch der ganzen Herde gehören1. Auch Koinfektionen mit Mycoplasmen, Circoviren oder Influenza können krankmachenden Effekte durch PRRSV noch verstärken3,4,5. Die Symptome und Schäden durch eine PRRS-Infektion im Bestand werden durch die Impfung mit einem Lebendimpfstoff begrenzt16,6: Zahlreiche Feld- und Laborstudien haben bestätigt, dass geimpfte Tiere bei einer PRRS-Feldvirus-Infektion deutlich weniger klinische Symptome wie Atemwegs- oder Fruchtbarkeitsstörungen zeigen und die infizierten Schweine das Virus schneller und effektiver bekämpfen, als wenn die Tiere nicht geimpft waren 18,6,16,19,20. Außerdem scheiden geimpfte Tiere nach einer Infektion wesentlich weniger Virus aus und stecken somit weniger Tiere im Bestand an – die Infektion wird begrenzt und Infektionsketten unterbrochen 17.
Welche finanziellen Schäden verursacht PRRSV?
PRRSV senkt die Produktivität der Schweineproduktion in allen Phasen der Produktion. Je nach Betrieb und individueller Situation können sich diese Kosten ganz unterschiedlich zusammensetzen:
Eine aktuelle Praxisstudie6 hat drei unterschiedliche Ferkelerzeugerbetriebe, in die das PRRS-Virus über Sperma eingetragen wurde, über einen längeren Zeitraum begleitet. Die Höhe der finanziellen Schäden in diesen Betrieben durch den PRRSV-Eintrag lag im Mittel bei 133 Euro pro Sau (68 – 211 Euro/Sau). Am besten überstanden hat den PRRS-Einbruch Betrieb Nr.2 (siehe Grafik), in dem die Schweine schon vorher mit einer Lebendvakzine gegen PRRSV geimpft wurden (68 Euro/Sau).
Zusammengesetzt haben sich die Schäden aus reduzierten biologischen Leistungen, erhöhten Tierarzt und Laborkosten und einem erhöhten Arbeitsaufwand der Landwirte. Die Gesamthöhe, aber auch die Höhe der einzelnen Posten unterschied sich zwischen den einzelnen Betrieben (siehe Grafik). Zu den ausgewerteten biologischen Leistungen zählten u.a. vermehrte Aborte, eine verringerte Anzahl abgesetzter Ferkel und erhöhte Aufzuchtverluste. Die angefallenen Kosten im Bereich Tierarzt/Labor setzen sich zusammen aus einem Mehraufwand durch Beratung, Impfung und Diagnostik. Wobei hier die Kosten noch zu gering geschätzt wurden, da die Betriebe eine finanzielle Unterstützung durch die Tiergesundheitsdienstmitgliedschaft erfahren haben. Der genannte zusätzliche Zeitaufwand wurde vom Landwirt geschätzt und als Lohnansatz 25 Euro pro Stunde angenommen.
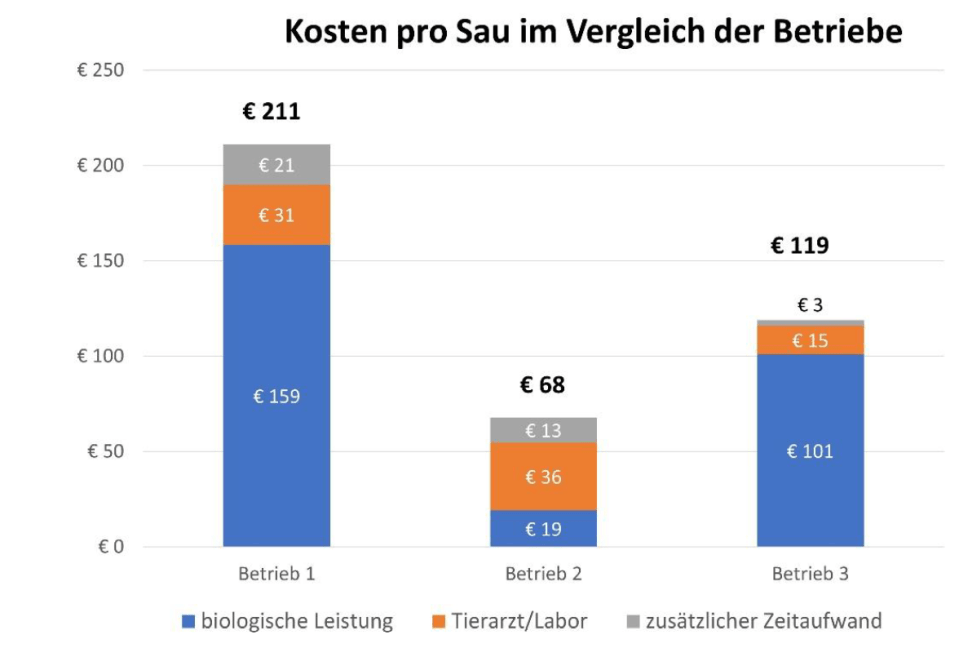
Die Autoren der Untersuchung diskutieren sogar, ob man die Schäden nicht sogar unterschätzt hat, da die Auswertung nach 18 Wochen beendet wurde, das Virus aber deutlich länger in Betrieben zirkulieren kann.
Die Daten dieser Untersuchung decken sich mit Auswertungen anderer Studien (126 Euro/ Sau7, 121 US Dollar/Sau8) und verdeutlichen, dass ein PRRSV-Eintrag teuer werden kann. Da die ökonomischen Folgen einer PRRS-Infektion betriebsindividuelle unterschiedlich sein können, bietet MSD Tiergesundheit Ihnen die Möglichkeit, die Kosten von PRRS auf Basis eines Rechenmodells für Ihren konkreten Bestand zu kalkulieren.
Woher weiß ich, ob PRRSV ein Problem in meinem Bestand ist?
Häufig steht am Anfang der Diagnostik der Verdacht durch Landwirt und Tierarzt, dass etwas im Tierbestand nicht stimmt (siehe „Welche Schäden verursacht PRRSV“).
Um diesen Verdacht abzuklären und eine mögliche PRRSV-Infektion nachzuweisen, ist die Auswahl des richtigen Untersuchungsmaterials und der richtigen Labormethode ganz entscheidend.
Es gibt zwei grundlegend unterschiedliche Methoden zum Nachweis einer PRRSV-Infektion:
Im direkten Nachweisverfahren werden Genombestandteile des Virus nachgewiesen. Hierfür wird in den meisten Fällen die PCR (Polymerase Ketten Reaktion) verwendet. Dieses Verfahren ist sehr genau und quantifiziert sogar die Menge des nachgewiesenen PRRS-Virus in der untersuchten Probe.
Im Vergleich dazu, können auch indirekte Nachweisverfahren verwendet werden, welche die Reaktion des Tieres auf den Kontakt mit dem Virus nachweisen. Hier werden Antikörper gemessen. Sie entstehen ca. 2 Wochen nach der Infektion bzw. Impfung mit PRRSV. Der Antikörper-Test (ELISA) kann aber nicht unterscheiden, ob die Antikörper infolge einer Impfung oder Infektion gebildet wurden, daher ist dieser Test in geimpften Herden nur sehr eingeschränkt nützlich.
Das häufigste Untersuchungsmaterial ist Blut. Hierbei gilt immer zu bedenken, dass das Virus bei erkrankten Tieren nur eine begrenzte Zeit im Blut nachweisbar ist. Das heißt, wenn ich zu spät komme kann meine Probe trotz vorhergehender PRRSV-Infektion auch negativ ausfallen. Ebenfalls kann man Organproben aus der Sektion oder Abortmaterial untersuchen1.
Zum Monitoring von größeren Tiergruppen im Betrieb können auch Kaustrickproben oder Hodensaftproben auf das Vorkommen von PRRS-Virus untersucht werden. Dies ist kostengünstig und einfach durchzuführen, sollte aber im Krankheitsfall durch gezielte weitere Diagnostik ergänzt werden9. Jede der beschriebenen Methoden hat Vor- und Nachteile. Daher sollte die Auswahl der Proben und der geeigneten Methode immer in Absprache mit Ihrem bestandsbetreuuenden Tierarzt erfolgen. MSD Tiergesundheit unterstützt Sie und Ihren Tierarzt hier selbstverständlich gern mit Know-how und Erfahrung.
Was bedeutet bei PRRS MLV Impfstoffen eigentlich „alt“?
Das Ziel einer PRRSV-Impfung ist es eine möglichst geschlossene Herdenimmunität im Tierbestand zu erreichen. Neben der Verhinderung klinischer Symptome soll durch die PRRS Impfung auch die unkontrollierte Viruszirkulation und damit Virusausbreitung im Bestand unterbunden werden2.
Die aktuellen Impfstoffe können in zwei große Kategorien unterteilt werden: inaktivierte Totimpfstoffe und modifizierte Lebendimpfstoffe, sogenannte „modified live viruses (MLV)“.
Diese Lebendimpfstoffe basieren auf einem im Feld isolierten PRRS-Virus Stamm, der im Labor durch viele Passagen, also das mehrfache Anzüchten in der Zellkultur, seine krankmachenden Eigenschaften immer weiter verloren hat10 . Man macht sich zu Nutze, dass diese abgeschwächten Impfviren sich nach der Injektion im Tier vermehren und so eine Infektion nachahmen. Der Körper wird so stimuliert eine effektive Immunantwort, vergleichbar zu der bei einer realen PRRSV-Infektion, auszubilden. Dieser Prozess wird durch Wirkverstärker, sogenannte Adjuvantien, unterstützt 11. Die auf dem Markt befindlichen Impfstoffe basieren auf verschiedenen PRRS-Virusstämmen, die im Feld isoliert wurden. Der Zeitpunkt des Markteintrittes eines Impfstoffes erlaubt keinen Rückschluss darauf, wann der zu Grunde liegende Feldstamm isoliert wurde oder wie lange er überhaupt schon existiert. PRRS Viren können über Jahre im Labor konserviert und aufbewahrt werden. So findet sich in keinem der auf dem deutschen Markt befindlichen Lebendimpfstoffe ein PRRS-Virusstamm, der nach 2004 isoliert wurde. Und das ist auch nicht entscheidend für Wirksamkeit und Sicherheit eines Impfstoffes. Hier spielen andere Eigenschaften eine wichtigere und entscheidende Rolle.
Welche Eigenschaften spielen denn bei der Wahl eines PRRSV-Impfstoffes eine Rolle?
Bei der Beurteilung eines Impfstoffes sind 2 Dinge entscheidend: Die Wirksamkeit eines Impfstoffes, also wie effektiv kann er eine gute Immunantwort hervorrufen, und die Sicherheit eines Impfstoffes.
- Die Wirksamkeit:
Die Impfung mit PRRS-Lebendimpfstoffen induziert im Prinzip die gleiche Immunantwort wie eine Feldvirusinfektion, da sich der Impfstamm in ganz ähnlicher Weise mit dem Immunsystem des Tieres auseinandersetzt10. Gegen den gleichen PRRS-Virusstamm wird eine vollständige Immunität ausgebildet, gegen etwas abweichende PRRS-Virusvarianten, wie es im Stall eigentlich immer der Fall ist, wird eine Kreuzimmunität ausgebildet1. Das bedeutet, dass die Schweine sich bei einem Feldvirus-Eintrag in den Bestand zwar noch infizieren können, aber einen deutlich besseren Gesundheitsstatus haben, die Ausscheidung von Feldvirus zum Beispiel über die Nase reduziert ist und sich damit weniger Tiere überhaupt anstecken im Vergleich zu nicht-geimpften Tieren 17,18,19,20. So zeigte sich in Feldversuchen der bessere Gesundheitsstatus in der Ferkelaufzucht nach PRRS-Impfung anhand reduzierter Verluste und besserer Tageszunahmen 32,33.
Eine Vorhersage zu Wirksamkeit oder Nicht-Wirksamkeit eines PRRS-Impfstoffes aufgrund genetischer Ähnlichkeit von PRRSV-Stämmen kann nicht gemacht werden31. Allerdings zeigen zahlreiche Labor- und Feldstudien, aber auch die langjährige Erfahrung aus dem Feld, dass der PRRS-Impfstoff von MSD eine zuverlässige Immunantwort gegen verschiedenste krankmachende PRRS-Stämme hervorruft 16,17,18,19,20.
- Nun zum zweiten Aspekt, der komplizierten Sache mit der Sicherheit:
Das Wichtigste vorweg: Die Impfstoff-Sicherheit ist grade für PRRSV-Impfstoffe wichtig: Die PRRS-Lebendvakzine sollte sich nur minimal ausbreiten und kein krankmachendes Potenzial besitzen.
Lebendimpfstoffe induzieren auf zellvermittelter Ebene eine deutlich bessere Immunantwort als eine Totvakzine 24, deshalb werden sie ja so breit im Feld eingesetzt 25. Allerdings können sich Lebendimpfstoffe im Tier und im Bestand weiter verbreiten10. Wie stark die verschiedenen Impfstoffe das tun wird für ihre Zulassung in Studien untersucht. Das Ergebnis dieser Studien findet sich im Beipackzettel der jeweiligen PRRS Impfstoffe wieder. Festzuhalten ist: Die Dauer der Ausscheidung des Impfvirus nach der Impfung und wie lange ein Impfvirus sich im Bestand hält unterscheidet sich erheblich zwischen den verschiedenen PRRS-Impfstoffen. Und das spiegelt auch die Erfahrung vieler Tierärzte im Stall wider.
Warum ist es jetzt relevant, wie lange und stark sich ein Impfvirus in einem Tier oder in einer Herde vermehrt? Nun, PRRS-Viren gehören zu einer ganz besonderen Gruppe von Viren (RNA-Viren): Einerseits unterliegen sie während ihrer Vermehrung ständigen Veränderungen (Mutationen), andererseits können sich verschiedene PRRS-Viren auch zu einem neuen, potenziell krankmachenden, PRRS-Virus zusammensetzen (rekombinieren) 27,28,29. Dies kann nur passieren, wenn sich in einem Schwein bzw. in einem Bestand verschiedene PRRS-Viren gleichzeitig vermehren. Die Rekombination zu neuen PRRS-Viren kann also auch sich vermehrende Impfviren beinhalten27,28,29. Dies ist grade 2019 in Dänemark geschehen27: Hier verursachte eine krankmachende Rekombination aus 2 verschiedenen PRRS-Impfviren einen schweren Krankheitsausbruch in über 38 Betrieben mit Fruchtbarkeitsstörungen und hoher Ferkelsterblichkeit27. Es ist anzunehmen, dass die Wahrscheinlichkeit solcher Rekombinationsereignisse mit der Dauer, die ein PRRS-(Impf-)Virus in einer Herde ausgeschieden wird und zirkuliert erheblich steigt. Schließlich sind dann einfach mehr PRRS-Viren zur selben Zeit am selben Ort. Deshalb sollen eben auch nicht gleichzeitig oder zeitnah verschiedene PRRS-Lebendimpfstoffe in einem Bestand eingesetzt werden30. Das sagt übrigens auch die EMA, die europäische Arzneimittelagentur, anlässlich der Geschehnisse in Dänemark und empfiehlt einen sorgfältigen Umgang mit PRRS-Impfstoffen29. Außerdem gibt es Berichte über PRRS-Impfviren, die infolge ihrer aktiven Vermehrung in Schweinen ihre früheren krankmachenden Eigenschaften zurückgewonnen haben und Probleme im Stall verursacht haben (die sogenannte Reversion)10. Dies ist zwar theoretisch bei allen PRRSV-Lebendimpfstoffen möglich 10, wurde jedoch in der langen Einsatzdauer des MSD PRRS-Impfstoffes für diesen noch nicht berichtet.
Ist die frühe Ferkelimpfung per se die beste Wahl?
Die Antwort auf diese Frage ist nicht ganz so einfach und muss verschiedene Aspekte berücksichtigen:
- In der aktiven Immunabwehr gegen PRRSV spielen neben den sogenannten Antikörpern vor allem verschiedene Immunzellen eine ganz zentrale Rolle1: Denn nach dem Kontakt mit dem PRRS-Virus (Feld- oder Impfvirus) erzeugt der Körper eine komplexe Immunantwort aus Antikörpern und Abwehrzellen1. Verschiedene Grundlagenstudien legen den Schluss nahe, dass die nötigen Strukturen für eine solche effektive Immunantwort sich erst in den ersten Wochen nach der Geburt entwickeln 21,22. Dies könnte bedeuten, dass bei einer sehr frühen PRRSV-Impfung die gewünschte Immunantwort nicht optimal ausgebildet würde.
- Anders als unter experimentellen Bedingungen stammen die Ferkel im Stall in den allermeisten Fällen von Sauen, die vor der Geburt schon Kontakt zum PRRS Virus hatten: Entweder haben die Sauen in der Vergangenheit eine Feldvirusinfektion durchgemacht oder sie wurden gegen PRRSV geimpft12. In Folge dessen findet man häufig hohe Gehalte mütterlicher Schutzstoffe, sogenannte maternale Antikörper, im Blut der Saugferkel. Diese bilden, neben anderen Schutzstoffen, übertragen durch das Kolostrum der Sauen, den sogenannten „Nestschutz“ der Ferkel13. Aktuelle Untersuchungen zeigen, dass diese mütterlichen Antikörper im Ferkel die Wirksamkeit der PRRSV-Ferkelimpfung negativ beeinflussen könnten. Dies ist, besonders bei hohen Gehalten wie sie in jungen Ferkeln vorkommen, der Fall14.
Aufgrund dieser Überlegungen sollte immer bestandsindividuell gemeinsam mit dem betreuenden Tierarzt abgewogen werden, welcher Impfzeitpunkt in diesem Betrieb optimal und notwendig ist. Ziel ist es, die Ferkel zwar rechtzeitig vor dem ersten Viruskontakt (häufig in der Ferkelaufzucht) zu schützen, andererseits wollen wir bei der Investition in die Impfung natürlich auch eine möglichst effektive Immunantwort erreichen. Fazit: Früher heißt eben nicht automatisch besser.
Quellen
- Zimmermann et al., 2019, Porcine Reproductive and Respratory Syndrome (Porcine Arterivirus). In: Diseases of Swine 11th edition 2019. Ed Zimmermann J, Karriker L, Ramirez A, Schwartz K, Stevenson G, Zhang J. Blackwell Publishing. 685- 708
- Grosse Beilage et al., 2013 Diagnostik, Prophylaxe und Therapie von Atemwegserkrankungen in Schweinebeständen, 1.Auflage 2013. Grosse Beilage E, Wendt M. Stuttgart, Eugen Ulmer. 200-270
- Thacker et al. 1999 Mycoplasma hyopneumoniae potentiation of porcine reproductive and respiratory syndrome virus-induced pneumonia. J. Clin. Microbiol. 1999; 37:620-627
- Allan et al. 2000 Experimental infection of colostrum deprives piglets with porcine circovirus 2 (PCV2) and porcine reproductive and respiratory syndrome virus (PRRSV) potentiates PCV2 replication. Arch. Virol. 2000; 145:2421-2429
- Van Reeth et al. 2001 Clinical effects of experimental dual infections with porcine reproductive and respiratory syndrome virus followed by swine influenza virus in conventional and colostrum-deprived pigs. J. Vet. Med. B. Infect. Dis. Vet. Public Health 2001; 48:283-292
- Oppeneder et al 2020 Ökonomische Auswirkung eines PRRS-Viruseintrages mittels Sperma in Betrieben mit unterschiedlichem PRRSV-Status. Berliner und Münchener Tierärztliche Wochenschrift 133 (2020)
- Nieuwenhuis et al. 2012 ; Economic analysis of outbreaks of porcine reproductive and respiratory syndrome virus in nine sow herds. Vet.Rec.
Neumann et al. 2005 Assessment of the economic impact of porcine reproductive and respiratory syndrome on swine production in the United States. JAVMA, Vol 227, No. 3:385-392 - Hernandez-Garcia et al 2017 The use of oral fluids to monitor key pathogens in porcine respiratory disease complex. Porcine Health Management (2017) 3:7
Renunkaradhya et al. 2015 Live porcine reproductive and respiratory syndrome virus vaccines; Current status and future direction. Vaccine 33 (2015) 4069–4080 - Murtaugh et al. 2011 Immunological solutions for treatment and prevention of porcine reproductive and respiratory syndrome (PRRS). Vaccine 29 (2011) 8192–8204
- Alexopoulos et al. 2005 Sow performance in an endemically porcine reproductive and respiratory syndrome (PRRS)-infected farm after sow vaccination with an attenuated PRRS vaccine. Veterinary Microbiology 111 (2005) 151–157
- Geldhof et al. 2013 Antibody response and maternal immunity upon boosting PRRSV-immune sows with experimental farm-specific and commercial PRRSV vaccines. Veterinary Microbiology 167 (2013) 260–271
- Renson et al. 2019 Maternally-derived neutralizing antibodies reduce vaccine efficacy
against porcine reproductive and respiratory syndrome virus infection. Vaccine 37 (2019) 4318–4324 - Fablet et al 2016 Maternally-derived antibodies (MDAs) impair piglets’ humoral and cellular immune responses to vaccination against porcine reproductive and respiratory syndrome (PRRS). Veterinary Microbiology 192 (2016) 175–180
- Dhom et al. 2015 Cross-sectional study one year after an acute PRRS outbreak. Poster ESPHM Dublin 2016
- Pileri et al. 2015 Vaccination with a genotype 1 modified live vaccine against porcine reproductive and respiratory syndrome virus significantly reduces viremia, viral shedding and transmission of the virus in a quasi-natural experimental model. Veterinary Microbiology 175 (2015) 7-16
- Martelli et al 2009 Efficacy of a modifies live porcine reproductive and respiratory syndrome virus (PRRSV) vaccine in pigs naturally exposed to a heterologous European (Italian cluster) field strain: Clinical protection and cell-mediated immunity; Vaccine 27 (2009) 3788-3799
- Diaz et al. 2018; Efficacy of three commercial live vacciines against porcine reproductive and respiratory syndrome virus (PRRSV) in weaned piglets; Poster 2018; Universitat Autonoma de Barcelona
- Pejsak & Markowska-Daniel 2006 Ransomised, placebo-controlled trial of a live vaccine against porcine reproductive and respiratory syndromevirus in sows on inefected farms; The Veterinary Record (2006) 158, 475-478
- Stokes et al. 2004 Postnatal development of intestinal immune system in piglets: implications for the process of weaning. Animal Research 53 (2004) 325-334.
- Butler et al. 2009 The piglet as a model for B cell and immune system development. Veterinary Immunology and Immunopathology 128 (2009) 147-170.
- Ladinig, Andrea 21.10.2019 Diagnosetechniken: Kann der Schutz gegenüber PRRS gemessen werden? Homepage: https://www.3drei3.de/artikel/kann-der-schutz-gegenuber-prrs-gemessen-werden_2503/. Zugriff am 17.03.2021
- Toman et al. 2019 Dynamics and Differences in Systemic and Local Immune Responses After Vaccination With Inactivated and Live Commercial Vaccines and Subsequent Subclinical Infection With PRRS Virus. Frontiers in Immunology 10 (2019) Article 1689
- Chae 2021 Commercial PRRS Modified-Live Virus Vaccines. Vaccines 2021,9,185
- Nielsen et al. 2001 Reversion of a live porcine reproductive and respiratory syndrome virus vaccine investigated by parallel mutations. Journal of General Virology (2001), 82, 1263-1272
- Kvisgaard et al 2020 A recombination between two Type 1 Porcine Reproductive and Respiratory Syndrome Virus (PRRSV-1) vaccine strains has caused severe outbreaks in Danish pigs. Transboundary and Emerging Diseases 2020; 67; 1786-1796.
- Renson et al. 2017 Complete Genome Sequence of a Recombinant Porcine Reproductive and Respiratory Syndrome Virus Strain from Two Genotype 1 Modified Live Virus Vaccine Strains. Viruses 5 (2017); 22
- Suvaxyn PRRS MLV: EPAR – Product Information. First published 21/09/2017. Updated 09/09/2020. Zugriff am 17.03.2021. https://www.ema.europa.eu/en/medicines/veterinary/EPAR/suvaxyn-prrs-mlv#product-information-section
- Vaccination PRRS in pigs: the recommendations of the Anses to limit recombination of vaccine strains. Zugriff 17.03.2021: https://www.anses.fr/en/content/vaccination-prrs-pigs-recommendations-anses-limit-recombination-vaccine-strains.
- Diaz et al. 2006 Different European-type vaccines against porcine reproductive and respiratory syndrome virus have different immunological properties and confer different protection to pigs. Virology 351 (2006) 249-259
- Alvarez et al. 2015 Effect of PRRS infection on PCV2 vaccination efficacy and measures to control the negative impact. ESPHM Nantes Poster 2015
- Laza et al 2017 Strategic piglet vaccination as a tool to eliminate PRRS Virus recirculation in a commercial nursery. ESPHM Prag Poster 2017
