Allgemeines zu equinen Herpesviren (EHV)
Morphologie
Wie alle Vertreter der Familie der Herpesviridae sind auch die equinen Herpesviren behüllte, etwa 250 nm große Partikel. Die Viren besitzen ein doppelsträngiges DNA-Genom, das in ein ikosaedrisches Nukleokapsid verpackt wird. In die äußere Hülle sind Glykoproteine eingebaut, die für die initiale Infektion der Wirtszelle und die Virusreplikation wichtig sind. Andererseits agieren sie auch als Antigene und sind Ziel der antiviralen Immunantwort.
Die equinen Herpesviren stammen aus zwei Unterfamilien (Alpha – und Gammaherpesvirinae).
Virusspezies
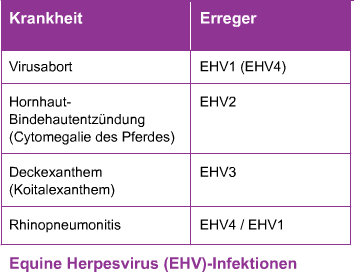
Bei domestizierten Pferden wurden bislang fünf equine Herpesvirusspezies diagnostiziert. Dies sind EHV1 bis EHV5. Während EHV1, EHV3 und EHV4 zur Unterfamilie der Alphaherpesvirinae gehören, sind EHV2 und EHV5 Mitglieder der Unterfamilie der Gammaherpesviridae.
Von wirtschaftlicher Bedeutung sind vor allem EHV1 und EHV4, die große genetische und antigenetische Gemeinsamkeiten (Homologien) von 65-85% aufweisen (Riggio et al. 1989). Diese große Ähnlichkeit erklärt auch die zu beobachtende serologische Kreuzreaktivität.
Von der Virusspezies EHV1 existieren zwei Phänotypen, die sich in der DNA-Polymerase an der Aminosäureposition 752 unterscheiden (single nucleotid polymorphism):
• D752: hohes neuropathogenes Potential
• N752: nur in 10-25% neurologische Symptome, dafür vorwiegend für Aborte verantwortlich
(Lunn et al. 2009)
EHV1 verursacht zusammen mit dem EHV4 die größten wirtschaftlichen Schäden (Patel und Heldens 2005). Während das EHV4 (s. Kapitel EHV4 – Respiratorische Erkrankungen), das auch Rhinopneumonitisvirus genannt wird, überwiegend für Erkrankungen des oberen Respirationstrakts verantwortlich ist, verursacht EHV1 vor allem Aborte (s. Kapitel EHV1 – Aborte) und neurologische Erkrankungen, die mit Lähmungen und Paralysen und zum Teil mit dem Tod des Tieres verbunden sind. Insbesondere das neurologische Krankheitsbild, das auch als Schlaganfall des Pferdes oder Equine Herpesvirus Myeloenzephalopathie (s. Kapitel EHV1 – neurologische Störungen) bezeichnet wird, gewinnt zunehmend an Bedeutung. EHV1 kann aber auch respiratorische Symptome beim Pferd hervorrufen und tritt häufig gemeinsam mit EHV4 auf (APHIS 2007).
Latenz
Eine weitere charakteristische Erregereigenschaft ist die intranukleäre Latenz der Viren im Trigeminalganglion und im Falle von EHV1 auch im lymphoretikulären System (Slater 2007, Lunn et al. 2009). Unter Latenz wird der Zustand einer reversiblen, nicht produktiven Infektion einer Zelle durch ein replikationskompetentes Virus bezeichnet.
Die Latenz der Herpesviren stellt eine wichtige epidemiologische Strategie zum Überleben sowie zur Ausbreitung in der natürlichen Wirtspopulation dar. Nach Erstinfektion zieht sich das Virus erst einmal in diese Nischen zurück. Durch endo- und exogene Stressoren wie Transporte oder Geburten sowie andere Ursachen, die zu einer Immunsuppression des Pferdes führen wie beispielsweise die Gabe von Kortikosteroiden, kann es zu einer Reaktivierung des Virus und zu einer Virusausscheidung kommen (Lunn et al. 2009). Ein weiteres Risiko sind Rangordnungskämpfe, wie sie nach Einführung neuer Pferde in eine Herde oder durch Umstallungen zu beobachten sind.
Die Latenz kann aber auch lebenslang im infizierten Wirt bestehen bleiben (Welch et al. 1992). Sowohl die Virusvermehrung als auch die Ausscheidung sind beim adulten Tier häufig nur von milden klinischen Symptomen begleitet, wodurch das Erkennen eines infizierten Tieres noch erschwert wird.
Herpesinfektionen sind in der Pferdepopulation weit verbreitet (Reed 2005). Schätzungsweise sind bis zu 60% und mehr Pferde weltweit latent mit EHV1 und /oder EHV4 infiziert (Lunn et al. 2009).
Aber auch in Deutschland hatte fast jedes Pferd, genauer gesagt 85 – 90%, schon einmal Kontakt mit einem equinen Herpesvirus. So beträgt die Seroprävalenz für EHV4 nahezu 100%, für EHV1 wird der serologisch positive Anteil etwa auf 50-80% geschätzt. Daher werden auch in klinisch gesunden, nicht geimpften Beständen kaum seronegative Tiere gefunden.
Eine Infektion mit equinen Herpesviren ist jedoch altersunabhängig und damit jederzeit möglich. Jedoch infizieren sich vermutlich die meisten Pferde während der ersten Lebenswochen oder -monaten (Foote 2004).
Weitere Erregereigenschaften
Wegen der lipidhaltigen Hülle ist das Virus empfindlich gegenüber Reinigungsmitteln und Lipidlösungsmitteln. Der Erreger ist hitze- und säurelabil und wird bei 56°C innerhalb von 5-10 Minuten inaktiviert (Zellkulturvirus), im Bereich von 20-40°C bleibt das Virus mehrere Tage vermehrungsfähig. An Oberflächen behält das Virus unter Ausschluss von UV-Bestrahlung und in Abhängigkeit vom Feuchtigkeitsgrad der Trägersubstanz im Temperaturbereich von 22-35°C seine Infektiosität bis zu 48 Tage, im Temperaturbereich um 4°C sogar bis zu sieben Monate. Fäulnis sowie pH-Werte unter vier und über zehn inaktivieren das Virus rasch (Verter et al. 1999).
Der zytopathische Effekt (lytische Vermehrung) ist charakterisiert durch die Bildung intranukleärer Einschlusskörper, Synzytien – und Riesenzellbildung (Weinbrenner 2004).
Die Fähigkeit zur latenten Infektion erklärt sich auch aus einer mangelnden Erkennbarkeit des Virus für das Immunsystem. Daher bleibt eine immunologisch bedingte Selektion, wie diese z.B. für das equine Influenzavirus charakteristisch ist, aus. Dies führt dazu, dass beide equinen Herpesviren antigenetisch sehr stabil sind und bislang keine allmählich fortschreitenden Veränderungen der Epitopstruktur ihrer Oberflächenproteine zeigen (Allen 2002).
Virusübertragung & -vermehrung
Die wichtigste Art der Virusübertragung ist die intranasale Schmier- und Tröpfcheninfektion durch Aufnahme von virushaltigen Sekreten der Atemwege infizierter Tiere, vorwiegend durch Schnauben und direkten Kontakt. Die Übertragung durch Aerosole hängt von der Infektiösität des Virus, den Klimabedingungen und dem Abstand zwischen den Tieren ab (van Maanen 2002). Für die Viruskonzentration in der Luft spielt es auch eine wichtige Rolle, ob die Pferde auf der Weide oder in geschlossenen Ställen gehalten werden. Bedeutende Infektionsquellen stellen zudem abortiertes Fetalmaterial, die Nachgeburt und die Fruchthüllen dar, die große Mengen an infektiösem EHV1 enthalten (Slater 2007).
Anschließend findet die erste Virusvermehrung in den Epithelzellen des Atmungstraktes statt. Während EHV1 danach virämisch im Organismus verbreitet wird und stark endotheliotrop ist, verbleibt EHV4 meist in den Zellen des Respirationstraktes und den dazugehörigen Lymphknoten.
Die Virämie ist auch deshalb so erfolgreich, weil die Herpesviren über zahlreiche Mechanismen verfügen, die eine Reaktion des Immunsystems verhindern. So können die Viren über die Plasmamembranoder auch von Zelle zu Zelle direkt wandern (Lunn et al. 2009).
Latent infizierte Pferde stellen ein Virusreservoir dar und scheiden das Virus unbemerkt, mal mehr mal weniger stark aus. Dadurch erhöht sich der Infektionsdruck im Bestand.
Diagnostik
Eine Differenzierung von EHV1 und 4 gegenüber anderen respiratorischen Erregern anhand des klinischen Erscheinungsbildes ist nicht möglich. EHV1 und 4 verursachen keine pathognomonischen Krankheitsanzeichen. Daher muss die Diagnose mittels Laboruntersuchungen gesichert werden.
Für den Virusnachweis (PCR) beim Vorliegen der respiratorischen Form eignet sich am besten Nasenrachenexsudat, das möglichst früh in der fieberhaften Phase mit synthetischen Nasenrachentupfern, z.B. Virocult, entnommen werden sollte. Geeignete Nasentupfer können auch vom OIE Referenzzentrum an der FU Berlin zusammen mit dem Transportmedium angefordert werden.
Bei EHV1 bedingten Aborten sind Nachgeburten und Teile des Fetus für den Nachweis wesentlich. Das Virus kann in der Regel aus Leber, Lunge, Milz und Thymus des Föten isoliert werden (Smith et al. 2002). Hierbei ist wichtig, dass auch die Plazenta untersucht wird, da bei EHV1 bedingten Aborten auch virusnegative Föten angetroffen werden (Smith et al. 2002). Auch die Fruchtwässer sind stark mit dem Erreger kontaminiert.
Der Fetus selbst darf natürlich nur in pathologischen Einrichtungen eröffnet werden und ist zu diesem Zwecke einzuschicken.
Bei neurologischen Verläufen ist auch der Nachweis von Virus aus dem peripheren Blut angezeigt. Dies sollte bei Verdacht am besten als EDTA – Blutprobe rasch und gekühlt (nicht gefroren) an ein entsprechendes Labor geschickt werden, wobei es bei der Untersuchung auf die Blutzellen ankommt, nicht auf das Serum. Der Virusnachweis erfolgt dann mittels quantitativer PCR. Je nach Labor wird zusätzlich noch eine Virusisolierung durchgeführt.Nach Impfungen, nach Infektionen oder nach vermuteter Infektion,sind auch ein Serumpaar und der Nachweis von EHV1 und/oder von EHV4-spezifischer Antikörper im Abstand von 2-3 Wochen eine Möglichkeit, eine Infektion oder einen Impferfolg nachzuweisen.
Der indirekte Erregernachweis erfolgt mittels eines Antikörpernachweises, entweder durch den Serumneutralisationstest, die Komplementbindungsreaktion oder mit einem ELISA.
